உலர்ந்த கலமானது மின்சாரம் உற்பத்தி செய்யும் மூலத்தின் எளிய வடிவமாகும். பல செல்கள் ஒருங்கிணைந்த செல்கள் ஒன்றாக பேட்டரியை உருவாக்குகின்றன. தி ஈய அமிலம் அல்லது நிக்கல்-காட்மியம் மின்கலம் உலர் கலத்தின் மேம்பட்ட பதிப்பு. இந்த கலத்தை முதன்முதலில் 1866 ஆம் ஆண்டில் பிரெஞ்சு பொறியியலாளர் ஜார்ஜஸ் லெக்லாஞ்ச் கண்டுபிடித்தார். அவரது கண்டுபிடிப்புக்கு லெக்லாஞ்ச் பேட்டரி என்று பெயரிடப்பட்டது. ஆனால் அந்த நேரத்தில், அது மிகவும் கனமாக இருந்தது, எளிதில் உடைக்கப்படலாம். உலர்ந்த கலத்திற்கு அதே கொள்கை உள்ளது மற்றும் இது லெக்லாஞ்ச் பேட்டரியின் மேம்பட்ட பதிப்பாகும் மற்றும் வெவ்வேறு மின்னழுத்தத்திலும் அளவுகளிலும் வருகிறது. லெக்லாஞ்ச் பேட்டரியின் மாற்றியமைக்கப்பட்ட வடிவமான துத்தநாக-கார்பன் கலத்தின் வணிக வடிவம் 1881 ஆம் ஆண்டில் மைன்ஸின் கார்ல் காஸ்னர் என்பவரால் கண்டுபிடிக்கப்பட்டது. இது பெரிய அளவில் தயாரிக்கப்படுகிறது மற்றும் பொம்மைகள், ரேடியோக்கள், கால்குலேட்டர்கள் போன்ற பல பயன்பாடுகளில் பயன்படுத்தப்படுகிறது.
உலர் செல் என்றால் என்ன?
உலர்ந்த செல் என்பது இரசாயன எதிர்வினைகளின் அடிப்படையில் மின்சாரத்தை உருவாக்கும் சாதனமாகும். கலத்தின் இரண்டு மின்முனைகள் ஒரு மூடிய பாதை வழியாக இணைக்கப்படும்போது, செல் எலக்ட்ரான்களை ஒரு முனையிலிருந்து மற்றொன்றுக்கு ஓடுமாறு கட்டாயப்படுத்துகிறது. எலக்ட்ரான்களின் ஓட்டம் மூடிய சுற்றுகளில் மின்னோட்டத்தை பாய்ச்சுகிறது.

உலர் செல் அடுக்குகள்
வேதியியல் எதிர்வினைகளின் உதவியுடன், எலக்ட்ரான்கள் ஒரு முனையிலிருந்து மற்றொன்றுக்கு பாய்கின்றன. இரண்டு அல்லது அதற்கு மேற்பட்ட செல்கள், சரியான துருவமுனைப்புடன் இணைக்கப்படும்போது, அதிக திறன் காரணமாக அதிக எலக்ட்ரான்கள் பாய்கின்றன. இந்த கலவையை பேட்டரி என்று அழைக்கப்படுகிறது. குறைந்தபட்ச மின்னழுத்தம் 1.5 V முதல் 100 V வரை, ஒரு மின்கலத்தை ஒரு மின்னழுத்த வரம்பைப் பெற பயன்படுத்தலாம். பேட்டரியின் வெளியீட்டு டிசி மின்னழுத்தம் கூட பவர் எலக்ட்ரானிக் கன்வெர்ட்டர்களைப் பயன்படுத்தி வெவ்வேறு நிலைகளுக்கு கட்டுப்படுத்த முடியும் இடைநிலை சுற்றுகள்.
கலத்தின் அமைப்பு
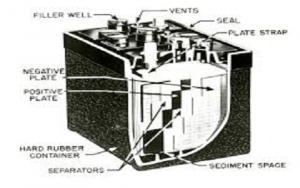
துத்தநாகம்-கார்பன் உலர் கலத்தின் அமைப்பு படத்தில் காட்டப்பட்டுள்ளது. இது அனோட் முனையத்தை துத்தநாகமாக அல்லது பொது கிராஃபைட் கம்பியாகக் கொண்டுள்ளது. கார்பன் கத்தோட் முனையத்தை உருவாக்குகிறது. உலர்ந்த கலத்தின் பழைய பதிப்புகளில் துத்தநாகம் கேத்தோடாகவும், கிராஃபைட் ஆனோட் முனையமாகவும் பயன்படுத்தப்பட்டது என்பதைக் காணலாம். தனிமங்களின் தேர்வு அடிப்படையில் தனிமங்களின் வெளிப்புற சுற்றுப்பாதையின் வேதியியல் உள்ளமைவை அடிப்படையாகக் கொண்டது.

உலர் செல் அமைப்பு
வெளிப்புற சுற்றுப்பாதையில் அதிக எண்ணிக்கையிலான எலக்ட்ரான்கள் இருந்தால், அது ஒரு நன்கொடையாளராக செயல்பட முடியும், எனவே கேத்தோடை உருவாக்குகிறது. இதேபோல், வெளிப்புற சுற்றுப்பாதையில் குறைவான எலக்ட்ரான்கள் இருந்தால், அதை எளிதில் ஏற்றுக்கொள்ள முடியும், எனவே ஆனோடை உருவாக்குகிறது. இடையில் வைக்கப்பட்டுள்ள எலக்ட்ரோலைட் ரசாயன எதிர்வினைகளுக்கு ஒரு ஊக்கியாக செயல்படுகிறது. பொதுவாக, அம்மோனியம் குளோரைடு ஜெல்லியை எலக்ட்ரோலைட்டாகப் பயன்படுத்துகிறோம். காட்டப்பட்டுள்ள படத்தில், பயன்படுத்தப்படும் எலக்ட்ரோலைட் துத்தநாகம் மற்றும் குளோரைடு கலவையாகும். மேலும், சோடியம் குளோரைடு எலக்ட்ரோலைட்டாகவும் பயன்படுத்தப்படுகிறது. மாங்கனீசு டை ஆக்சைடு மற்றும் கார்பனின் கலவையானது அனோட் தடியைச் சுற்றி சூழப்பட்டுள்ளது.
முழு உள்ளமைவும் ஒரு உலோக குழாயில் வைக்கப்பட்டுள்ளது. கலத்தின் மேற்புறத்தில் ஒரு சுருதியைப் பயன்படுத்துவதன் மூலம் ஜெல்லி வறண்டு போகாமல் தடுக்கப்படுகிறது. ஒரு கார்பன் வாஷர் கீழே வைக்கப்பட்டுள்ளது. இந்த வாஷரின் நோக்கம் துத்தநாக அனோட் தடி கொள்கலனுடன் தொடர்பு கொள்ளாமல் தடுப்பதாகும்.
வரைபடத்தில் காட்டப்பட்டுள்ளபடி இது ஸ்பேசர் என்றும் அழைக்கப்படுகிறது. துத்தநாகம் கேன் காப்பு நோக்கங்களுக்காக காகித காப்பு மூலம் சூழப்பட்டுள்ளது. பெரிய பேட்டரிகளுக்கு, மைக்கா போன்ற பிற இன்சுலேடிங் பொருட்களும் பயன்படுத்தப்படுகின்றன. எல் இன் நேர்மறை முனையம் மேலே உருவாகிறது. கலத்தின் எதிர்மறை முனையம் அடிவாரத்தில் உருவாகிறது.
உலர் கலத்தின் வேலை
ஒரு உலர்ந்த செல் அடிப்படையில் வேதியியல் எதிர்வினைகளில் செயல்படுகிறது. எலக்ட்ரோலைட்டுக்கும் மின்முனைகளுக்கும் இடையில் நிகழும் எதிர்வினைகள் காரணமாக, எலக்ட்ரான்கள் ஒரு மின்முனையிலிருந்து மற்றொன்றுக்கு பாய்கின்றன. அமிலங்கள் போன்ற பொருட்கள் நீரில் கரைந்து அயனியாக்கம் செய்யப்பட்ட துகள்கள் உருவாகின்றன. அயனியாக்கம் செய்யப்பட்ட துகள் இரண்டு வகையாகும். நேர்மறை அயனிகள் கேஷன்ஸ் என்றும் எதிர்மறை அயனிகள் அயனிகள் என்றும் அழைக்கப்படுகின்றன. நீரில் கரைந்த அமிலங்கள் எலக்ட்ரோலைட்டுகள் என்று அழைக்கப்படுகின்றன.
மேலே குறிப்பிட்டுள்ள வரைபடத்தில், துத்தநாக குளோரைடு எலக்ட்ரோலைட்டாக உருவாகிறது. இதேபோல் அம்மோனியம் குளோரைடு ஜெல்லியும் ஒரு எலக்ட்ரோலைட்டாக உருவாகிறது. எலக்ட்ரோலைட்டுகளில் மூழ்கிய உலோக தண்டுகள் மின்முனைகளை உருவாக்குகின்றன. உலோக தண்டுகளின் வேதியியல் பண்புகளின் அடிப்படையில், அனோடாக ஒரு நேர்மறையான மின்முனையும், கத்தோடாக எதிர்மறை மின்முனையும் உள்ளன.
மின்முனைகள் எதிரெதிர் சார்ஜ் செய்யப்பட்ட அயனிகளை அவற்றின் பக்கமாக ஈர்க்கின்றன. எடுத்துக்காட்டாக, கேத்தோடு அனான்களை ஈர்க்கிறது மற்றும் அனோட் கேஷன்ஸை ஈர்க்கிறது. இந்த செயல்பாட்டில் எலக்ட்ரான்கள் ஒரு திசையிலிருந்து மற்றொன்றுக்கு பாய்கின்றன, எனவே நாம் கட்டணங்களின் ஓட்டத்தைப் பெறுகிறோம். இது அழைக்கப்படுகிறது தற்போதைய .
வேதியியல் எதிர்வினைகள்
கலத்தில் நடைபெறும் எதிர்வினைகள் கீழே காட்டப்பட்டுள்ளன. முதலாவது ஆக்சிஜனேற்றம் எதிர்வினை.

இதில், துத்தநாகம் கத்தோட் இரண்டு அயனிகளை வெளியிடும் நேர்மறை சார்ஜ் செய்யப்பட்ட துத்தநாக அயனிகளுக்கு ஆக்ஸிஜனேற்றப்படுகிறது. இந்த எலக்ட்ரான்கள் அனோடால் சேகரிக்கப்படுகின்றன. பின்னர் குறைப்பு எதிர்வினை வருகிறது.

அனோடில் குறைப்பு எதிர்வினை மேலே காட்டப்பட்டுள்ளது. இந்த எதிர்வினை மின்சாரத்தை உருவாக்குகிறது. இது மெக்னீசியம் ஆக்சைடுடன் ஆக்சைடு அயனிகளை வெளியிடுகிறது. மெக்னீசியம் எலக்ட்ரோலைட்டுடன் இணைந்தால் இந்த எதிர்வினை உருவாகிறது.


மற்ற இரண்டு எதிர்வினைகள் உலர்ந்த கலத்தில் நடைபெறும் அமில-அடிப்படை எதிர்வினை மற்றும் மழைவீழ்ச்சி எதிர்வினை ஆகியவற்றைக் குறிக்கின்றன. அமில-அடிப்படை எதிர்வினையில், NH ஆனது OH உடன் இணைந்து தண்ணீருடன் NH3 ஐ உருவாக்குகிறது. இதன் விளைவுகள் NH3 மற்றும் நீர் தளம்.
உலர் செல் மற்றும் ஈரமான கலத்திற்கு இடையிலான வேறுபாடு
உலர்ந்த கலத்திற்கும் ஈரமான கலத்திற்கும் இடையிலான முக்கிய வேறுபாடு எலக்ட்ரோலைட்டின் வடிவம். முன்பு விவாதித்தபடி, உலர்ந்த கலத்தில், அம்மோனியம் குளோரைடு போன்ற எலக்ட்ரோலைட் இயற்கையில் வறண்டு காணப்படுகிறது. இத்தகைய உலர்ந்த செல்கள் மிகவும் பொதுவானவை மற்றும் பொம்மைகள், ரேடியோக்கள் போன்றவற்றில் பயன்படுத்தப்படுகின்றன. ஆனால் ஈரமான கலத்தில், எலக்ட்ரோலைட் திரவ நிலையில் உள்ளது.
ஆபத்தான அரிக்கும் திரவமான சல்பூரிக் அமிலம் போன்ற திரவ எலக்ட்ரோலைட்டுகள் பயன்படுத்தப்படுகின்றன. இத்தகைய திரவங்களின் தன்மை காரணமாக, ஈரமான கலமானது இயற்கையில் அதிக வெடிக்கும் மற்றும் கவனத்துடன் கையாளப்பட வேண்டும். அத்தகைய ஈரமான கலங்களின் சிறந்த நன்மை என்னவென்றால், அவை எளிதில் ரீசார்ஜ் செய்யப்பட்டு ஏராளமான பயன்பாடுகளுக்குப் பயன்படுத்தப்படலாம். இத்தகைய பேட்டரிகள் விமானப் போக்குவரத்து, பயன்பாடுகள், ஆற்றல் சேமிப்பு மற்றும் செல்போன் கோபுரங்களில் பொதுவான பயன்பாட்டைக் காண்கின்றன.
உலர் செல் செயல்பாடுகள்
எலக்ட்ரோடு மற்றும் எலக்ட்ரோலைட்டுகளுக்கு இடையிலான வேதியியல் எதிர்வினைகளின் அடிப்படையில் உலர்ந்த செல் செயல்பாடு. எலக்ட்ரோலைட்டுகளில் எலக்ட்ரோட்கள் வைக்கப்படும்போது, அது தங்களை நோக்கி எதிர் சார்ஜ் செய்யப்பட்ட அயனிகளை ஈர்க்கிறது. இது கட்டணங்களின் ஓட்டத்தை ஏற்படுத்துகிறது, எனவே மின்னோட்டம் தயாரிக்கப்படுகிறது.
நன்மைகள்
தி உலர்ந்த கலத்தின் நன்மைகள் பின்வருவனவற்றை உள்ளடக்குங்கள்.
- உலர்ந்த செல் போன்ற பல நன்மைகள் உள்ளன
- இது அளவு சிறியது.
- இது பல்வேறு மின்னழுத்த மட்டங்களில் வரலாம்.
- இது எளிது மற்றும் ஏராளமான பயன்பாடுகளைக் கொண்டுள்ளது.
- டிசி மின்னழுத்தத்தின் ஒரே ஆதாரம் இது.
- வெளியீட்டு மின்னழுத்தத்தை சீராக்க சக்தி மின்னணு சுற்றுகளுடன் இதைப் பயன்படுத்தலாம்
- இது ரீசார்ஜ் செய்யக்கூடியது.
தீமைகள்
தி உலர்ந்த கலத்தின் தீமைகள் பின்வருவனவற்றை உள்ளடக்குங்கள்.
- அதை கவனமாக கையாள வேண்டும்
- இது வெடிக்கும்
- பெரிய மதிப்பீட்டு பேட்டரிகள் மிகவும் கனமானவை
பயன்பாடுகள்
தி உலர்ந்த கலத்தின் பயன்பாடுகள் பின்வருவனவற்றை உள்ளடக்குங்கள்.
- பொம்மைகள்
- விமானப் போக்குவரத்து
- கைபேசிகள்
- வானொலி
- கால்குலேட்டர்
- கடிகாரங்கள்
- கேட்டல் எய்ட்ஸ்
எனவே இதன் செயல்பாடு, வகைப்பாடு மற்றும் பயன்பாடுகளை நாங்கள் கண்டோம் உலர்ந்த செல்கள் . கவனிக்க வேண்டிய ஒரு சுவாரஸ்யமான விஷயம் என்னவென்றால், மின்முனைகள் ஒருவருக்கொருவர் உடல் ரீதியாக தொடர்பு கொள்ளும்போது மட்டுமே பேட்டரி செயல்படுகிறது. இரண்டு மின்முனைகளுக்கிடையில் ஒரு நடத்தும் ஊடகம் இருக்க வேண்டும். உலர்ந்த கலத்தின் மின்முனைகளுக்கு இடையில் ஒரு கடத்தும் ஊடகமாக தண்ணீரைப் பயன்படுத்த முடியுமா என்பது கேள்வி. அவ்வாறான நிலையில், இந்த கலத்தை தண்ணீரில் நனைத்தால் என்ன நடக்கும்?